Disocierea electrică: fundamentele teoretice ale electrochimiei
Disocierea electrică joacă un rol imensîn viața noastră, deși de obicei nu ne gândim la asta. Prin acest fenomen este legată conductivitatea sărurilor, acizilor și bazelor într-un mediu lichid. Deoarece primele de ritm cardiac cauzate de un „viu“ cu energie electrică în corpul uman, dintre care optzeci la sută constă din fluide, pentru mașini, telefoane mobile și playere, baterii reîncărcabile, care sunt în mod inerent baterii electrochimice, - peste tot în jurul nostru prezent în mod invizibil disociere electrică.

În vaporii giganți care emit vapori otrăvițidin metoda de electroliză a bauxitului la temperatură înaltă topită, se produce aluminiu metalic "înaripat". Toate obiectele din jurul nostru, de la grilajele cromate ale radiatoarelor până la cerceii argintii din urechi, au întâlnit vreodată soluții sau topiri de săruri și, prin urmare, cu acest fenomen. Cunoașterea disocierii electrice este studiată de întreaga ramură a științei - electrochimie.
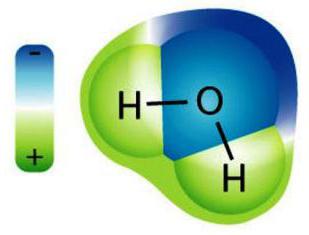
Când se dizolvă molecula lichid-solventintră într-o legătură chimică cu moleculele substanței dizolvate, formând solvați. Într-o soluție apoasă de disociere, sărurile, acizii și bazele sunt cele mai sensibile. Ca urmare a acestui proces, moleculele substanței dizolvate se pot deforma în ioni. De exemplu, sub influența unui solvent apos, ioni de Na+ și CI-, localizat în cristalul de NaCI ionic, trece în mediul de solvent într-o calitate deja nouă a particulelor solvatate (hidratate).
Acest fenomen, care în esența sa este un procesdizolvarea totală sau parțială a substanței dizolvate în ioni ca urmare a acțiunii solventului și se numește "disociere electrică". Acest proces este extrem de important pentru electrochimie. De mare importanță este faptul că disocierea sistemelor complexe multicomponente este caracterizată printr-un flux pas cu pas. Acest fenomen este, de asemenea, marcat de o creștere accentuată a numărului de ioni din soluție, care distinge substanțele electrolitice de cele neelectrolitice.
În timpul electrolizei, ionii au o claritatedirecție: particulele cu o sarcină pozitivă (cationi) - la electrodul încărcat negativ, numită catod și ionii pozitivi (anioni) - la electrodul anod de sarcină opusă, în cazul în care acestea sunt evacuate. Cationii sunt redusi, iar anionii sunt oxidati. Prin urmare, disocierea este un proces reversibil.
Una dintre caracteristicile fundamentale ale acestui lucruproces electrochimic este gradul de disociere electrolitica, care se exprimă prin raportul dintre particulele hidratate la numărul total de molecule dizolvate substanțe. Cu cât este mai mare această valoare, cu atât este mai puternic electrolitul. Pe această bază, toate substanțele sunt împărțite în electroliți slabi, medii și puternici.
Gradul de disociere depinde de următorii factori: a) natura substanței dizolvate; b) natura solventului, a permeabilității și polarității sale dielectrice; c) concentrația soluției (cu cât această valoare este mai mică, cu atât mai mare este gradul de disociere); d) temperatura mediului de dizolvare. De exemplu, disocierea acidului acetic poate fi exprimată prin următoarea formulă:
CH3COOH H+ + CH3COO-
Electroliții puternici disociază practicireversibile, deoarece în soluția lor apoasă nu există molecule originale și ioni nehidratați. De asemenea, trebuie adăugat că toate substanțele care au un tip polar chimic ionic și covalent sunt susceptibile de disociere. Teoria disocierii electrolitice a fost formulată de fizicianul și chimistul suedez Svante Arrhenius în anul 1887.
</ p>